Protonen-Spektrum von Ethylbenzol mit Spin-Spin-Kopplung
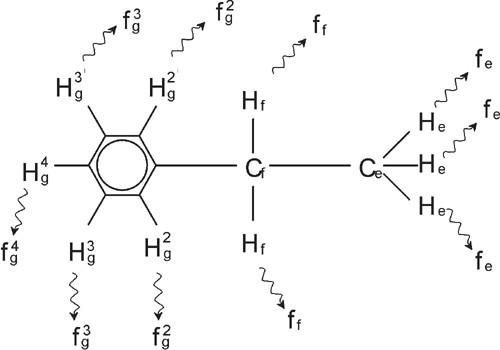
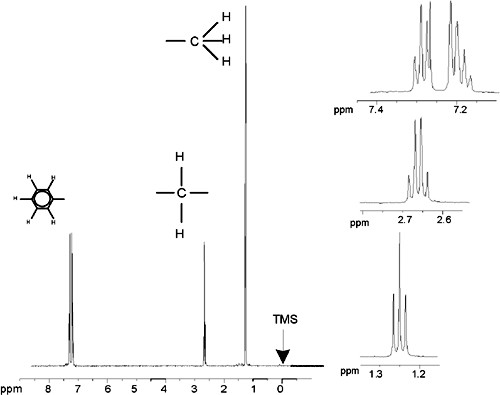
In den bisherigen Beispielen gestattete der Umstand, dass es sich bei allen Signalen – mit Ausnahme derer vom Benzol-Ring bei Benzylacetat – um Singuletts handelte, eine besonders einfache Beschreibung der Protonen-NMR-Spektren. Die Abbildungen „Ethylbenzol“ und „Ethylbenzol-Spektrum“ zeigen die Struktur und das zugehörige Protonen-Spektrum der organischen Verbindung Ethylbenzol. Wie zuvor wurden die Protonen nach den drei grundlegenden atomaren Umgebungen in drei Gruppen unterteilt und entsprechend bezeichnet.
Der auffälligste Unterschied zwischen den Signalen in diesem Spektrum und denen im Benzylacetat-Spektrum ist die Aufspaltung in Multipletts. Bei dem von den CH3-Protonen ausgesandten Signal handelt es sich um ein Triplett, bei dem von den CH2-Protonen ausgesandten Signal gar um ein Quartett. Beachten Sie auch, dass die Signallagen nicht übereinstimmen. Beim Benzylacetat senden die CH3-Protonen ein Signal bei 1,85 ppm aus, wohingegen die entsprechenden CH3-Protonen von Ethylbenzol ein Triplett-Signal bei 1,25 ppm aussenden. Dies ist kaum verwunderlich, da sich die beiden CH3-Gruppen in unterschiedlichen chemischen Umgebungen befinden.
Ursächlich für die Aufspaltung in Multipletts ist ein als Spin-Spin-Kopplung bezeichneter Effekt. Eine umfassende Behandlung dieses Effekts würde den Rahmen dieses Handbuch sprengen; der Leser sei hier auf die Standardtexte zur NMR-Spektroskopie verwiesen. Für unsere Zwecke soll ein kurzer Abriss zur Spin-Spin-Kopplung genügen.
Ethylbenzol
Ethylbenzol-Spektrum
Die in der Abbildung „Ethylbenzol-Spektrum“ erkennbare Aufspaltung der NMR-Signale resultiert aus einer magnetischen Wechselwirkung zwischen benachbarten Protonen. Die beiden Hf-Protonen sind magnetisch äquivalent und beeinflussen einander nicht. Ebenso sind die drei He-Protonen magnetisch äquivalent und beeinflussen einander nicht. Die beiden Hf-Protonen und die drei He-Protonen befinden sich jedoch in unterschiedlichen lokalen Umgebungen und „koppeln“ über die Bindungselektronen. Diese Kopplung führt letztlich dazu, dass die beiden Gruppen von Protonen einander beeinflussen, was die Aufspaltung der NMR-Signale zur Folge hat.
In Kombination können die beiden Hf-Protonen in drei möglichen magnetischen Konfigurationen vorliegen (dies ist eine Folge der Spin-Ausrichtung, daher auch die Bezeichnung „Spin-Spin-Kopplung“). Als Ergebnis dieser Kopplung schwingen die He-Protonen auf drei möglichen Frequenzen mit, so dass ein Triplett zu beobachten ist.
Analog bewirken die He-Protonen eine Aufspaltung der Hf-Signale. Die drei „He“-Protonen können in Kombination in vier möglichen magnetischen Konfigurationen vorliegen, wodurch die Hf-Protonen auf vier möglichen Frequenzen mitschwingen und das Signal somit in ein Quartett aufgespalten wird.
Auch die von den Benzol-Ring-Protonen ausgesandten Signale sind aufgrund der magnetischen Nicht-Äquivalenz und der daraus resultierenden Spin-Spin-Kopplung aufgespalten. Es stellt sich nun die Frage, warum die CH2-und CH3-Protonen des Ethylbenzols einander beeinflussen, wohingegen die beiden vergleichbaren Protonen-Gruppen des Benzylacetats dies nicht tun. Die Antwort ist in der Anzahl der Bindungen, durch die die beiden Gruppen getrennt sind, zu suchen. Bei Ethylbenzol sind die beiden Protonen-Gruppen an benachbarte Kohlenstoffatome gebunden, so dass eine hinreichende Wechselwirkung erwartet werden kann. Bei Benzylacetat hingegen liegen zwischen den beiden Kohlenstoffatomen Cc und Cb ein Sauerstoffatom und ein weiteres Kohlenstoffatom und damit zwei weitere Bindungen. Dies hat zur Folge, dass die beiden Protonen-Gruppen zu weit voneinander entfernt sind, um noch eine relevante Spin-Spin-Kopplung zu erfahren.